動物用レムデシビルも使用できるようになりました!
経口GSに続いて動物用レムデシビルも猫伝染性腹膜炎(FIP:feline infectious peritonitis)の治療に使用できるようになりました。
現在の新規受付状況はこちらを確認ください
→https://kami-ah.com/blog/archives/140
これで世界的なコンセンサスのあるレムデシビル・経口GS治療が可能となり、重症例でも適正に治療できるようになりました。
経口GSについてはこちら
https://kami-ah.com/blog/archives/133
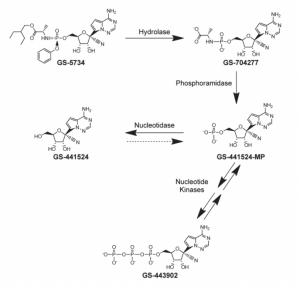
レムデシビル(remdesivir:GS-5734)は人のコロナウイルス(COVID-19)でも承認されている薬品で、GS-441524のプロドラッグ(体の中で代謝されてGS-441524になる薬)です。猫でも同様の代謝が行われ、GS-441524として効果が得られることが認められております。海外での医薬品としての治療はレムデシビルが経口GSよりも先立って行われており、医薬品としての治療成績は一番多いかもしれません(文献はあまり多くはないですが)。
動物用レムデシビルのメリットは濃度が濃いことです。人用のレムデシビル(商品名:ベクルリー)に比べ濃度が2倍になっています。人は静脈内注射のみですが、猫ちゃんの場合は皮下注射を実施する場合も多く、その際には投与量が人用の濃度だと多くなるため濃度が濃くなっています。またレムデシビルはGS441524の注射よりも痛みが少ないとされていますので、その点も皮下注射をする場合のメリットです(痛くないわけではないです)。
コストは経口GSに比べて高くなるので、基本的には重症例など内服が困難な場合の初期治療が適応になると考えています。海外での経験的なプロトコールでもレムデシビルで導入し、経口GSに切り替えていく方法が一般的です。
FIPの治療方法については色々と議論があると思いますが、こちらでは動物用医薬品であるメリットをお話しします。
当院で取り扱いしている経口GSおよびレムデシビルは動物用医薬品です。誤解のないようにお伝えすると海外で承認されている動物用医薬品で日本では未承認です。未承認なら今までのものと同じじゃないのと思われるかもしれませんが、日本でなくても動物用医薬品として承認されているということはとても大切でそれは成分と品質の違いになります。医薬品であるためには当然ながら正式な医薬成分が含まれていて、一定の品質が求められるからです。
FIPの治療薬の話でよく承認・未承認の話が出ますが、獣医師からするとさほど問題には思っていません。というのも他の病気でも効果があるのはわかっているけど日本国内では手に入らない薬というのはたくさんあって、普段から未承認の海外薬を用いているからです(先生から海外の薬ですと言われるものは大半がそうだと思います)。したがって、日本で承認されているかどうかは問題ではなく、そのものの効果や安全性のほうが大切で当院で取り扱いっているものはそれをクリアしていると考えております。
薬でもないものを薬と言ったり、薬用成分を含んでいると言いながら健康食品・サプリメントとすることの方が法律的には問題であると思っています。また、逆に人で承認されているものがあるから動物に大丈夫とも言えないので気をつける必要もあります(動物種によって薬の効き方や代謝の違いがあります)。
話を戻しますが医薬成分とはGS441524ですが、まず文献データは多くがGSに基づいているため成分が一致すればそのデータが参考にできます。GSに似ているものとはいえ違いがあれば、それは直接的に当てはめるわけにはいきませんのでデータの集積ができません。それは効果の検討もできず(残念ながらなくなった子がいたときに成分が足りなかったのか、その他の製品自体に問題があったのか、病気の進行として治療が難しかったのかなど)、その後の治療に生かすことができません。
事実、レムデシビルと経口GSの治療についてはプロトコールが確立されてきており、それはDr.Pedersenが当初発表した薬用量よりも開始用量が多くなっています(注射の成分、経口の違いもありますが)。当初の考えは投与して再発したら増量という考え方でしたが、それでは如何せんコストがかかるのでそれならはじめから多めに使用して再発率を下げた方がコストダウンになるだろうという考え方からです。このように情報を集積してそのデータをもとにより良い治療方法を選択できるようになるのも成分がしっかりしており用量が明確だからです。
一方GS類似製品は多くのものが成分自体、またその用量が表示がされていません(というよりパッケージにもはいっていないことが多いです)。製品により成分名の表示があっても成分量の記載はまずありません。この薬剤は何キロ目安とされているだけだと思います。これは成分量の表示をすると誤差の指摘がされるからだと考えています(個人的な推測です)。医薬品とすると成分に大きく誤差があっては問題になるのでその誤差範囲という規定があります。それを考えてのことなのかなと思っておりますが、成分量がわからないと治らなかった場合に用量の問題を検討できずプロトコールの共有やアップデートができません。事実、前述の通りGSは投与量の増量が検討されておりますが、Mutianは当初より変わっていないと思われます。
GS類似製品の成分量は内容量としては多いともされておりますが(はっきりとはわかっていません)、それは注射よりも内服の方が効果を得るのに量がいるため(生体利用率が低いため)です。それもあり経口GSの薬用量もGSの注射よりも用量は多く設定されております。その上でFIPのタイプ(症状出方)によって薬用量が設定されているのですが、最大用量の20mg/kgでは腸管からの吸収が悪くなりさらに生体利用率が下がるとされておりますので最大用量の使用時には1日2回投与に分割して投与することが推奨されます。このように細やかに薬の用量の調整ができるのも薬用量が決まっていて、成分量がわかっているからできるのです。
また個人的に大きな問題だと思っているのが品質です。成分については効果がなければ使われることがないため、ある程度必要量が入っているのはわかります。前述の安定的な成分量というのも品質の一つですが、問題はその他に何が入っているか、混入物はないかです。成分については効いていたらなんとなく入っているなとわかるのですが、それ以外の成分の影響は目に見えない可能性があるからです。
承認された動物用医薬品はもちろん一定の品質が求められるため、外部のルールで基準が設けられています。しかし、医薬品でもない製品には適応されるルールはなく、その製品の品質はメーカーのモラルにまかさせれています。何が入っていても、逆に入っていなくてもばれなければOKだし、バレてもペナルティはないわけです。これが私にとってはとても不安でした。FIPの治療をちゃんとしても残念ながら亡くなってしまう子もいるわけですが、その際に投薬プロトコールやタイミングの問題だけではない不安が拭えないからです。詳細は割愛しますが、特許の件も含めていくつかの要件でモラルのある企業だと思えなかったからです。
とはいえ動物用医薬品は個人輸入が大変だったり(そもそも国内から発送されるものは個人輸入でもありませんが)、当院の経口GSやレムデシビルは獣医師でなければ契約してもらえないので入手が大変です。
入手が大変であったり製品によってはコストが高くなるため手軽さという点では不利と言わざるを得ませんが、私としてはちゃんとした医学的な治療と動物への安全性の点で動物用医薬品としての製品を使用したいと考えています。しかしながら、個人では輸入できる数に限りがあり、新規受付の制限が厳しくなっております。ご迷惑おかけして大変申し訳ございませんがご理解ください。
*直接来院いただいても薬剤の用意はできません。事前にご相談ください。
*電話での相談は対応しておりません。HPの問い合わせから電話連絡を希望いただいても対応できませんので、メールの連絡・受診確認をしてください(gmailを受信できるように設定ください)。
*処方に関しては直接来院いただける方のみとなりますので、相談も来院可能である患者様に限らせていただきます。